Hidrojen Elementi Doğada Atomik Halde Mi Bulunur
Zaten Destekçiyim
Özellikler
Hidrojen, "H" sembolü ile ifade edilen, atom numarası 1 olan kimyasal elementtir. Standart atom ağırlığı 1.008 olan hidrojen, periyodik tablodaki en hafif elementtir. Hidrojen, tüm baryonik kütlenin yaklaşık %75'ini oluşturan, evrende en bol miktarda bulunan elementtir. Hidrojen atomu içerisinde protondan meydana gelmiş bir çekirdek ve bir birim elektrondan oluşan elektron bulutu bulunmaktadır. Normal koşullarda hidrojen gazı bir diatomik molekül olarak bulunur. Bu diatomik molekülün kimyasal gösterimi H2'dir.[1]
Fiziksel Özellikler
Hidrojen; renksiz, kokusuz, tatsız, zehirli olmayan, ametal ve oldukça yanıcı bir gazdır. Sıvılaşması en zor ikinci gaz olarak da bilinen hidrojen, 1 atmosfer basınçta -252.77 °C'de ancak sıvılaşabilir. Sıvı hidrojenin hacmi, gaz halindeki hacminin sadece 1/700'ü kadardır.
Hidrojen, bilinen tüm yakıtlar içerisinde birim kütle başına en yüksek enerji içeriğine sahiptir. 1 kg hidrojen, 2,1 kg doğalgaz veya 2,8 kg petrolün sahip olduğu enerjiye eşdeğer bir enerjiye sahiptir. Ancak birim hacim başına enerji karşılaştırması yapıldığında, doğalgaz ve petrolden daha düşük bir orana sahiptir. 1.00794 g/mol’lük atomik kütlesi ile tüm elementler arasında en hafif elementtir.[2]
Kimyasal Özellikler
Hidrojenin keşfedilen ilk kimyasal özelliği, oksijenle birleştiğinde yanıcı reaksiyon göstererek suyu (H2O) oluşturmasıdır. Çoğu ametal elementle kovalent bileşikler oluşturduğundan, Dünya üzerindeki hidrojenin neredeyse hepsi, su veya organik bileşikler gibi moleküler formda bulunur.
Hidrojen, özellikle asit-baz reaksiyonlarında önemli bir rol oynar çünkü, çoğu asit-baz reaksiyonu çözünür moleküller arasında proton alış-verişini içerir. İyonik bileşiklerde hidrojen, hidrit olarak bulunduğunda negatif yüklü (yani anyon) veya pozitif yüklü (yani katyon) bir formda bulunabilir.
Bulunma Sıklığı ve Üretimi
Hidrojen, evrende bulunması en kolay olan elementlerin başında gelir. Evrenin keşfedilen kısmının yaklaşık %90'ının hidrojenden oluştuğu tahmin edilmektedir.[3] H2, kimya ve biyoloji laboratuvarlarında, genellikle diğer reaksiyonların bir yan ürünü olarak üretilir. 2020 yılına ait istatistikle göre, hidrojenin çoğunluğu (yaklaşık %95); doğal gazın buharla reformasyonu, metan gazının kısmi oksidasyonu ve kömür gazlaştırma yollarıyla fosil yakıtlardan üretilmektedir.[4] Dünyadaki hidrojenin %95'inden fazlası, buharlı metan gazı dönüştürme işlemi kullanılarak üretilmektedir. Bu reaksiyonda doğal gaz, karbon monoksit ve hidrojen üretmek için yüksek bir sıcaklıkta buharla reaksiyona girer. Bunun ardından, "su gaz değiştirme reaksiyonu" sonucunda karbondioksit üretilir.[5]
Uygulama ve Kullanım Alanları
Hidrojen, çoğu yıldızın enerji üretmek için "yaktığı" ham yakıttır. "Füzyon" olarak da bilinen aynı süreç, yeryüzünde kullanılmak üzere olası bir güç kaynağı olarak da incelenmektedir. Güneşin hidrojen arzının 5 milyar yıl daha sürmesi beklenmektedir.
Hidrojen, "ticari" açıdan da önemli bir elementtir. Büyük miktarlarda hidrojen, "Haber işlemi" adı verilen bir işlemle, amonyak (NH3) üretmek için havadaki nitrojen ile birleştirilir. Aynı zamanda, "hidrojenasyon" adı verilen bir işlemle de, yer fıstığı yağı gibi katı ve sıvı yağlara da eklenebilir. Sıvı hidrojen, süper iletkenlerin çalışmasında kullanılır ve sıvı oksijen ile birleştirildiğinde mükemmel bir roket yakıtı oluşturur.[3]
Neden Desteğe İhtiyacımız Var?
Aslında maddi destek istememizin nedeni çok basit: Çünkü Evrim Ağacı, bizim tek mesleğimiz, tek gelir kaynağımız. Birçoklarının aksine bizler, sosyal medyada gördüğünüz makale ve videolarımızı hobi olarak, mesleğimizden arta kalan zamanlarda yapmıyoruz. Dolayısıyla bu işi sürdürebilmek için gelir elde etmemiz gerekiyor. Bunda elbette ki hiçbir sakınca yok; kimin, ne şartlar altında yayın yapmayı seçtiği büyük oranda bir tercih meselesi. Ne var ki biz, eğer ana mesleklerimizi icra edecek olursak... Daha fazla göster
Aslında maddi destek istememizin nedeni çok basit: Çünkü Evrim Ağacı, bizim tek mesleğimiz, tek gelir kaynağımız. Birçoklarının aksine bizler, sosyal medyada gördüğünüz makale ve videolarımızı hobi olarak, mesleğimizden arta kalan zamanlarda yapmıyoruz. Dolayısıyla bu işi sürdürebilmek için gelir elde etmemiz gerekiyor.
Bunda elbette ki hiçbir sakınca yok; kimin, ne şartlar altında yayın yapmayı seçtiği büyük oranda bir tercih meselesi. Ne var ki biz, eğer ana mesleklerimizi icra edecek olursak (yani kendi mesleğimiz doğrultusunda bir iş sahibi olursak) Evrim Ağacı'na zaman ayıramayacağımızı, ayakta tutamayacağımızı biliyoruz. Çünkü az sonra detaylarını vereceğimiz üzere, Evrim Ağacı sosyal medyada denk geldiğiniz makale ve videolardan çok daha büyük, kapsamlı ve aşırı zaman alan bir bilim platformu projesi. Bu nedenle bizler, meslek olarak Evrim Ağacı'nı seçtik.
Eğer hem Evrim Ağacı'ndan hayatımızı idame ettirecek, mesleklerimizi bırakmayı en azından kısmen meşrulaştıracak ve mantıklı kılacak kadar bir gelir kaynağı elde edemezsek, mecburen Evrim Ağacı'nı bırakıp, kendi mesleklerimize döneceğiz. Ama bunu istemiyoruz ve bu nedenle didiniyoruz.
Destek Ol
Tarihi
Hidrojen bir element olarak kabul edilmeden önce, bilim insanları tarafından yıllarca yüksek miktarlarda üretildi. Yazılı kayıtlar, Robert Boyle'un demir ve asitlerle deney yaparken 1671 yılında hidrojen gazı ürettiğini gösterse de, hidrojen ilk olarak 1766'da Henry Cavendish tarafından ayrı bir element olarak kabul edildi.[3] James Dewar, 1898'de hidrojeni ilk defa "rejeneratif soğutma" amacıyla kullandı. Bunun ardından, kendi icadı olan termosu kullanarak hidrojeni sıvılaştırdı ve ertesi yıl, bilinen ilk katı hidrojeni üretmeyi başardı.[6]
Etimolojisi
1783'te Antoine Lavoisier, Cavendish ve Laplace'ın "hidrojen yakıldığında su oluşur" bulgusunu doğruladığında, bu elemente hidrojen adını verdi. Hidrojen, Yunanca "su" anlamına gelen "ὑδρο (hidro)" ve "yaratıcı" anlamına gelen "γενής (gen)" sözcüklerinden oluşmaktadır.[7]
Önlem ve Güven
Hidrojen hava ile temas ettiğinde, potansiyel patlamalar ve yangınlardan canlılar için boğucu olmaya kadar bir dizi tehlike oluşturabilir.[8] Ek olarak, sıvı hidrojen bir kriyojendir ve çok soğuk (-252.77 °C) olduğu için temas edilmesi halinde soğuk yakması (frostbite) riski barındırır.[9] Hidrojen birçok metalde çözünür ve metal üzerinde çeşitli çatlaklara yol açabilir. Dış havaya sızan hidrojen gazı kendiliğinden tepkimeye girerek tutuşabilir.[10] Hidrojen, yandığı zaman neredeyse hiç görünmeyen açık mavi bir alevle yanar (565,5 °C– 578,9 °C), bu nedenle kazara yanıklara yol açabilir.[11] Hidrojenin birçok fiziksel ve kimyasal özelliği, parahidrojen / ortohidrojen oranına bağlıdır. Bir diğer yandan, kritik patlama basıncı ve sıcaklığı gibi hidrojen patlama parametreleri, büyük ölçüde bulunduğu kabın geometrisine bağlıdır.[8]
İlginç Bilgiler ve Diğer
- İnsan vücudunun kütlesinin yaklaşık %10'u hidrojendir.
- Hidrojen çok hafif olduğu için bir zamanlar uçan balonlarda kullanıldı. Ancak, oldukça yanıcı yapısı nedeniyle çok tehlikeli hale geldi. Bu noktadan sonra hidrojen yerine helyum kullanılmaya başlandı.
Alıntı Yap
Okundu Olarak İşaretle
Paylaş
Sonra Oku
Notlarım
Yazdır / PDF Olarak Kaydet
Bize Ulaş
Yukarı Zıpla
İçeriklerimizin bilimsel gerçekleri doğru bir şekilde yansıtması için en üst düzey çabayı gösteriyoruz. Gözünüze doğru gelmeyen bir şey varsa, mümkünse güvenilir kaynaklarınızla birlikte bize ulaşın!
Bu içeriğimizle ilgili bir sorunuz mu var? Buraya tıklayarak sorabilirsiniz.
Soru & Cevap Platformuna GitBu İçerik Size Ne Hissettirdi?
Kaynaklar ve İleri Okuma
Evrim Ağacı'na her ay sadece 1 kahve ısmarlayarak destek olmak ister misiniz?
Şu iki siteden birini kullanarak şimdi destek olabilirsiniz:
kreosus.com/evrimagaci
Periyodik Tablo, Elektron Kabukları ve Orbitaller
If you're seeing this message, it means we're having trouble loading external resources on our website.
Bağlandığınız bilgisayar bir web filtresi kullanıyorsa, *.kastatic.org ve *.kasandbox.org adreslerinin engellerini kaldırmayı unutmayın.
Elektron kabukları ve Bohr atom modeli
Elektron dizilimleri ve periyodik tablo
- Helyum (Hestart text, H, e, end text), neon (Nestart text, N, e, end text) ve argon (Arstart text, A, r, end text) 18. grup elementleridir. Dış elektron kabukları tamamen doludur veya oktet kuralına uyarlar. Bu özellikleri onları oldukça kararlı yapar. Kararlı yapıları (reaktif olmamalarından) sebebiyle, bu elementler soygaz veya asal gaz olarak adlandırılırlar.
- Hidrojen (Hstart text, H, end text), lityum (Listart text, L, i, end text) ve sodyum (Nastart text, N, a, end text) 1. grup elementleridir. Dış elektron kabuklarında sadece 1 elektron bulundururlar. Tek atom halinde oldukça kararsızdırlar, ancak değerlik elektronlarından birini vererek veya paylaşarak kararlı hale geçebilirler. Eğer bu elementler bir elektronlarını tamamen kaybederlerse (lityum ve sodyumda olduğu gibi), pozitif yüklü iyonlar haline gelirler: Li+start text, L, i, end text, start superscript, plus, end superscript ve Na+start text, N, a, end text, start superscript, plus, end superscript.
- Flor (Fstart text, F, end text) ve klor (Clstart text, C, l, end text) 17. grup elementleridir. En dış kabuklarında yedi elektron bulunur. Kararlı oktet durumuna geçebilmek için başka atomlardan bir elektron alma eğilimindedirler. Böylece negatif iyonlar oluştururlar: F−start text, F, end text, start superscript, minus, end superscript ve Cl−start text, C, l, end text, start superscript, minus, end superscript
- Karbon (Cstart text, C, end text) 14. grup elementidir. Dış kabuğunda 4 elektron bulunur. Karbon, dolu bir değerlik kabuğu elde edebilmek için pek çok diğer atomla bağ kurarak elektronlarını paylaşır.
Alt kabuklar ve orbitaller
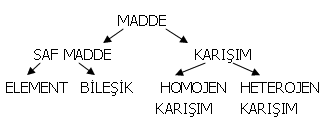
SAF MADDE: Kendisinden başka madde bulundur-mayan maddelere denir.
ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atom-lardır.
BİLEŞİK: En az iki farklı cins elementin belirli oranlarda bir araya gelerek, oluşturdukları yeni özellikteki maddeye denir. Yani bileşiklerin yapı taşı moleküldür.
MOLEKÜL: İki veya daha çok atomun bir araya gelerek oluşturduğu atom gruplarıdır.

Elementler :
Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir.
Bir elementi oluşturan bütün atomların büyüklükleri ve atomların arasındaki uzaklık aynıdır. Fakat bir elementin atomları ile başka bir elementin atomlarının büyüklükleri ve atomların arasındaki uzaklıkları farklıdır. Aynı elementten yapılan farklı maddeler de aynı cins atomlardan oluşurlar.
Elementi oluşturan atomların birbirine olan uzaklığı elementin katı, sıvı ve gaz haline göre değişebilir.
Canlı ve cansız varlıkların tamamı elementlerden oluşurlar.
Elementlerin Özellikleri :
1- En küçük yapı birimleri atomlardır.
2- Aynı cins atomlardan oluşurlar.
3- Kendinden daha basit ve farklı maddelere ayrılamazlar.
4- Saf maddelerdir.
5- Sembollerle gösterilirler.
Element Çeşitleri :
Atomik Yapıdaki Elementler :
Bazı elementleri oluşturan aynı cins atomlar doğada tek başlarına bulunurlar. Böyle atomlara sahip elementlere atomik yapılı elementler denir. Atomik yapılı elementlerin en küçük taneciği atomlardır.
Demir, bakır, alüminyum, çinko, kurşun, altın gibi elementler atomik yapılıdır.

Moleküler Yapıdaki Elementler :
Bazı elementleri oluşturan aynı cins atomlar doğada ikili (veya daha fazla sayıda atomdan oluşan karmaşık yapılı) gruplar halinde bulunurlar. Böyle atomlara sahip elementlere moleküler yapılı elementler denir. Moleküler yapılı elementlerin en küçük taneciği moleküllerdir.
ELEMENTLER VE SEMBOLLERİ:
Günümüzde bilinen 118 element vardır. Bu elementlerin 92 tanesi doğada bulunurken geri kalanı da laboratuarlarda elde edilen yapay elementlerdir.
Elementler sembollerle gösterilir ve her elementin kendine özgü sembolü vardır. Element sembolü yazılırken;
• Sembol tek harfli ise büyük harfle yazılır.
• Sembol iki veya üç harfli ise ilk harf daima büyük, diğer harfler küçük yazılır. (Sembollerin iki veya üç harften oluşmasının nedeni, bazı elementlerin baş harflerinin aynı olmasıdır).
Elementlerin sembollerle gösterilmesinin nedeni, bütün Dünya’da ortak bir bilim dili oluşturmak, bilimsel iletişimi ve yazımlarını kolaylaştırmaktır. Elementlerin bütün Dünya’da kullanılan sembolleri aynı olmasına rağmen isimleri dillere göre farklıdır. (Türkçe, Rusça, Çince, Japonca da element isimleri farklı olmasına rağmen sembolleri aynıdır).
Elementlerin sembolleri belirlenirken, elementlerin Latince isimlerinin ilk veya ilk iki (üç) harfi kullanılmıştır.
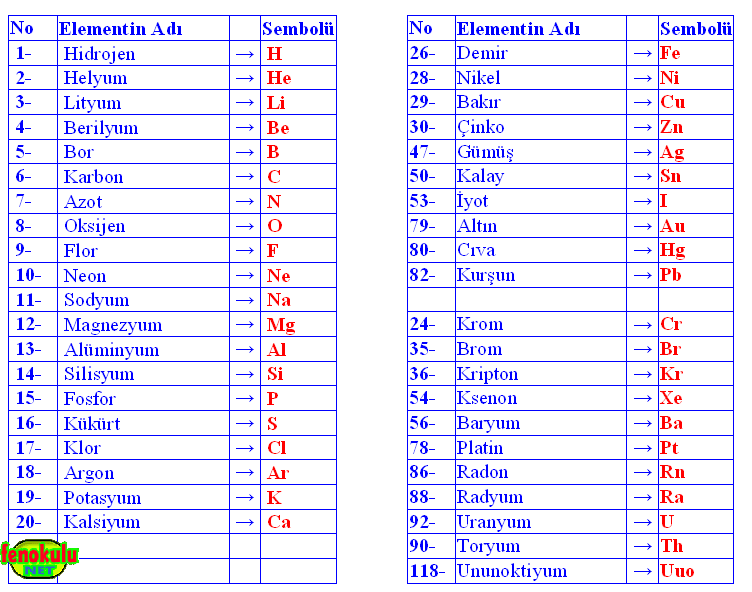
Tabloda ilk 20 elementin, numaraları, adları ve sembolleri gösterilmiştir. Bunları öğreniniz.
Elementler sembollerle gösterilir fakat sembollerden, o elementin atomik yapıda mı, moleküler yapıda mı olduğu anlaşılmaz. Moleküler yapıda olan elementlerin kaç atomdan oluştuğunun anlaşılması için formüller kullanılır:
Örneğin hidrojen, oksijen ve iyot elementleri iki atomludur. Kükürt 8, fosfor ise 4 atomludur.
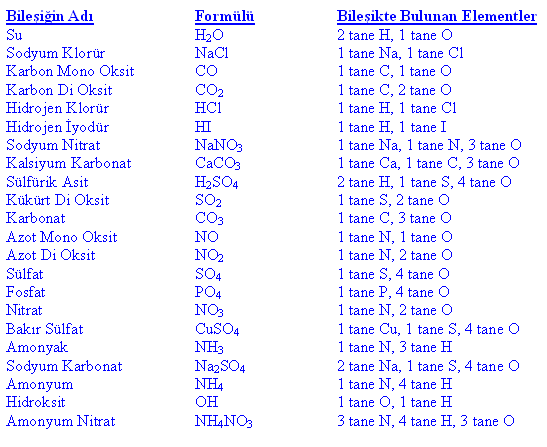
Bazı elementlerin sembol ve formülleri

İsimleri ve formülleri verilen bileşiklerde hangi elementten kaç tane bulunduğunun gösterimi
Elementlerin Kullanım Alanları ve Özellikleri :
1- Hidrojen (H) :
• İlk olarak 1776 yılında Henry Cavendish tarafından keşfedilmiştir.
• Hidrojen ismi ise Antoine Lavoisier tarafından verilmiştir.
• Bilinen renksiz en hafif gazdır.
• Suyun, canlıların ve petrol gibi birçok maddenin yapısında bulunur.
• Roket yakıtı olarak kullanılır.
2- Helyum (He) :
• 1868 yılında Fransız Pierre Janssen ve İngiliz Norman Lockyer birbirinden bağımsız olarak helyumu keşfetmişlerdir.
• 1908 yılında Heike Kamerlingh Onnes ilk sıvı helyumu elde etmiştir.
• Helyum atmosferde çok az miktarda bulunur.
• Güneş’te ve diğer yıldızlarda bol miktarda bulunur.
• Renksiz bir gazdır.
• Zeplin ve balon gibi hava taşıtlarının şişirilmesinde, roket yakıtlarının sıkıştırılmasında kullanılır. (Havadan daha hafif gaz olması nedeniyle).
3- Lityum (Li) :
• İlk olarak 1817 yılında Johann Arvedson tarafından keşfedilmiştir.
• Gümüşümsü gri metalik renkte bulunan katı bir elementtir.
• İlaçlarda, pil üretiminde, seramik ve cam yapımında kullanılır.
4- Berilyum (Be) :
• 1828 yılında birbirlerinden bağımsız olarak Friedrich Wöhler ve Antony Bussy tarafından elde edilmiştir.
• Gri renklidir katıdır.
• Uçak ve uzay araçlarının yapımında elektrik ve ısı iletkeni olarak kullanılır.
5- Bor (B) :
• 1808 yılında Humphry Davy, Gay–Lussac ve Thenard tarafından ilk defa elde edilmiştir.
• Oda koşullarında katı halde bulunur.
• Isıya dayanıklı renkli cam imalatında, seramiklerde ve roket yakıtlarında kullanılır.
6- Karbon (C) :
• Saf haldeyken karbon, elmas, grafit, is, kömür gibi (4 tane allotropu vardır) birçok çeşitli maddelerde bulunur.
• Grafitin yapısı siyah, elmasın yapısı ise renksiz bir katıdır.
• Yeryüzünde kömür, petrol, doğal gaz gibi maddelerin ve canlıların yapısında bulunup canlılar açısından çok önemlidir.
7- Azot (N) :
• Azot ilk olarak 1772 yılında Daniel Rutherford tarafından keşfedildi.
• Renksiz ve kokusuz bir gazdır.
• Canlılar için gerekli temel elementlerden biridir.
• Sıvı azot soğutma amacıyla kullanılır.
• Bazı azot bileşikleri tarımda gübre olarak kullanılır.
8- Oksijen (O) :
• Oksijen ilk olarak 1774 yılında Joseph Priestley ve Carl Wilhelm Scheele tarafından keşfedilmiştir.
• 1781 yılında Lavosier, oksijenin havada bulunan ve yanmaya etki eden bir madde olduğunu keşfetmiştir.
• Renksiz bir gazdır.
• Canlıların yaşaması için gerekli temel elementtir.
• Dalgıçların ve astronotların solunum yapmaları için kullandıkları oksijen tüplerinde bulunur.
9- Flor (F) :
• İlk defa 1886 yılında Henri Moissan tarafından elde edilmiştir.
• Açık sarı renkli bir gazdır.
• Diş macunları ve deodorantların yapısında bulunur.
• Buzdolabı ve klimaların soğutma sisteminin çalışmasında kullanılır.
10- Neon (Ne) :
• Neon 1898 yılında William Ramsay ve Morris Travers tarafından keşfedilmiştir.
• Renksiz bir gazdır.
• Renkli reklam panolarının aydınlatılmasında ve televizyon tüplerinde kullanılır.
11- Sodyum (Na) :
• Sodyum ilk olarak 1877 yılında Humphrey Davy tarafından elde edilmiştir.
• Yumuşak, kaygan bir metal olup gümüşümsü beyaz renkli bir katıdır.
• Doğada en çok sofra tuzunun (sodyum klorürün) yapısında bulunur.
• Kağıt, gıda, tekstil, kimya, sabun, cam ve metal gibi bir çok endüstriyel kullanılır.
12- Magnezyum (Mg) :
• 1755 yılında İngiltereli Joseph Black tarafından ilk olarak keşfedilmiştir.
• Gümüşümsü beyaz renkli bir metaldir.
• Oda koşullarında katı halde bulunur.
• Hafif bir metal olduğu için hava taşıtlarının yapımında kullanılır.
• Kurutulmuş meyvelerde bulunur.
13- Alüminyum (Al) :
• 1827 yılında Wohler tarafından bulunmuştur.
• Alüminyum yumuşak ve hafif bir metaldir.
• Mat, gümüşümsü renkli bir katıdır.
• Mutfak araç gereçlerinin, elektrik kablolarının ve içecek kutularının yapımında kullanılır.
14- Silisyum (Si) :
• Silisyumun ilk keşfi 1824 yılında Berzelius tarafından gerçekleştirilmiştir.
• Yeryüzünde en fazla bulunan elementlerden biridir.
• Koyu gri renkli bir katıdır.
• Kumda, kilde, cam yapımında ve yapı malzemelerinde bulunur.
15- Fosfor (P) :
• Fosfor ilk olarak 1669 yılında Hennig Brand tarafından keşfedildi.
• Fosfor renksiz, beyaz, kırmızı ve siyah renklerinde bulunabilir.
• Oda koşullarında katı halde bulunur.
• Canlıların sinir ve kemik dokularında görevlidir.
• Suni gübre yapımında kullanılır.
16- Kükürt (S) :
• Kükürt, antik çağda bilinen dokuz elementten biriydi. Kükürdün kimyasal bir element olduğunu 1777’de Lavoisier ortaya attı. 1810 yılında Gay Lussac ile Thenard tarafından deneysel olarak doğrulandı.
• Sarı renkli tatsız, kokusuz bir maddedir.
• Oda koşullarında katı halde bulunur.
• Isı ve elektriği iyi iletemez.
• Barut ve sülfürik asit yapımı ile kuru meyvelerde mikrop öldürücü olarak kullanılır.
17- Klor (Cl) :
• Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise Humphry Davy tarafından bugünkü ismi verildi.
• Sarı–yeşil renkli zehirli bir gazdır.
• Doğada en çok sofra tuzunun yapısında bulunur.
• İçme sularında mikrop öldürücü olarak bulunur.
18- Argon (Ar) :
• 1785 yılında havada argon olduğu ilk defa Henry Cavendish tarafından iddia edilmiş ve 1894 yılında Lord Rayleigh ve William Ramsay tarafından keşfedilmiş.
• Kokusuz ve renksiz bir gazdır.
• Ampullerde ve flüoresan tüplerinde kullanılır.
19- Potasyum (K) :
• Potasyum ilk olarak 1807 yılında Humphrey Davy tarafından elde edilmiştir.
• Gümüşümsü beyaz renkli bir katıdır.
• Sıvı deterjan, gübre, barut, cam ve lens yapımında kullanılır.
20- Kalsiyum (Ca) :
• İlk olarak 1808 yılında Berzelius ve Pontin tarafından, daha sonra saf olarak ilk defa Humphry Davy tarafından elde edilmiştir.
• Gümüş gibi parlak ve beyaz renkli bir katıdır.
• Çimento, alçı, kireç gibi maddeler ile dişlerin ve kemiklerin yapısında bulunur.
21- Gümüş (Ag) :
• Gümüş elementinin keşfi tam olarak bilinmemekle birlikte altın ve bakır elementlerinden sonra keşfedilmiştir. Gümüşün MÖ 2500 yıllarında Çinliler ve Persler tarafından kullanıldığı belirtilmiştir.
• Parlak, beyaz renkli bir katıdır.
• Süs eşyası yapımında, diş dolgusu (amalgam) yapımında kullanılır.
22- Altın (Au) :
• Tarihte bilinen kayıtlara göre Mısır hükümdarları zamanında MÖ 3200 yıllarında, altın darphanelerde eşit boyda çubuklar halinde çekilerek para olarak kullanıldı.
• Yumuşak, parlak sarı renkli bir katıdır.
• Süs eşyası yapımında kullanılır.
23- Cıva (Hg) :
• Cıva çok uçucu bir element olduğu için oda sıcaklığında kolayca buharlaşabilir.
• Gümüşümsü gri renkli bir sıvıdır.
• Zehirli bir elementtir.
• Herhangi bir yüzeye cıva döküldüğü zaman üzerine toz kükürt dökülmelidir.
• Diş dolgusu (amalgam) yapımında ve termometrelerde kullanılır.
24- Bakır (Cu) :
• Tarihte ilk defa 10.000 yıl kadar önce Kıbrıs’ta rastlanmıştır.
• Turuncu renkli yumuşak bir katıdır.
• Mutfak ve süs eşyası yapımında kullanılır.
25- Nikel (Ni) :
• Nikel elementi ilk olarak 1751 yılında Axel Fredric Cronstedt tarafından keşfedilmiştir.
• Gümüşümsü parlak renkli bir katıdır.
• Arabaların kaplamalarında, musluklarda ve paslanmaz tencere yapımında nikel kullanılır.
26- İyot (I) :
• İyot elementi ilk kez Bernard Courtois tarafından 1811 yılında keşfedilmiştir.
• Parlak, menekşe–siyah renkli bir katıdır.
• Deniz ürünlerinde ve iyotlu sofra tuzlarında bol miktarda bulunur.
27- Çinko (Zn) :
• Çinko elementi 1746 yılında Andreas Maggart tarafından keşfedilmiştir.
• Mavimsi, açık gri renkte, kırılgan bir katıdır.
• Mutfak eşyalarının ve pilin yapımında kullanılır.
28- Demir (Fe) :
• Demir metalinin keşfi tam olarak bilinmemektedir.
• Grimsi parlak renkli bir katıdır.
• Element halindeki saf demir dövülebilir, ince tel ve levha haline getirilebilir.
• İnşaat malzemesi ile günlük hayatta kullanılan bazı eşyaların yapımında kullanılır.
• Marul ve pekmez gibi besinlerle kanın yapısında bulunur.
29- Kalay (Sn) :
• MÖ 3000 yıllardan beri kullanılan bir elementtir.
• Gümüşümsü parlak renkli bir katıdır.
• Mutfak eşyası yapımında ve metallerin kaplanmasında kullanılır.
30- Kurşun (Pb) :
• Keşfi tam olarak bilinmemektedir.
• Mavimsi–beyaz renkte bulunan bir katıdır.
• Yumuşak, ağır, zehirleyici, kolay dövülebilen bir maddedir.
NOT : 1- Elementi oluşturan taneciklerin renkleri, elementlerin renkleriyle aynı olmayabilir.
Taneciklerin renkleri yoktur. Tanecikler bir araya gelerek elementleri oluşturduklarında yani elementler görünür boyuta ulaştıklarında renkli görünürler.
2- Farklı maddeler de aynı elementlerden oluşabilir yani farklı maddelerde aynı cins elemenler bulunabilir. Ispanak ve bezelyede bulunan demir atomlarıyla, demir parçasında bulunan demir atomları aynı atomlardır.
3- Doğada bilinen 118 element olmasına rağmen bu elementler farklı şekillerde bir araya gelerek milyonlarca yeni madde yani bileşik elde edilir.
Doğada Kullanılan Elementlerin Benzerliği :
Doğadaki canlı ve cansız varlıkların tamamı elementlerden oluşur. Canlı varlıkları oluşturan elementlerden bir kısmı aynı zamanda yeryüzünün yapısını da oluşturur. Aynı elementlerden oluştukları halde canlı vücudu, yeryüzü veya diğer maddelerin yapısı arasında farklılıkların bulunmasının nedeni, canlı vücudunu, yeryüzünü veya diğer maddeleri oluşturan elementlerin farklı sayı, çeşit ve şekillerde dizilmesidir.
Canlı Vücudunu Oluşturan Element Çeşitleri ve Bunların Oranları :
• Oksijen → % 65
• Karbon → % 18
• Hidrojen → % 10
• Azot → % 3
• Kalsiyum → % 2
• Fosfor → % 1,1
• Potasyum → % 0,35
• Kükürt → % 0,25
• Sodyum → % 0,15
70 Kg Kütleli İnsandaki Elementlerin Miktarları :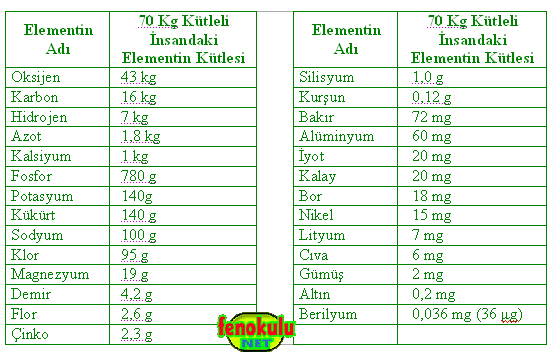
Yeryüzünde Bulunan Elementlerin Oranları :
• Oksijen → % 46,6
• Silisyum → % 27,7
• Alüminyum → % 8,1
• Demir → % 5,0
• Kalsiyum → % 3,6
• Sodyum → % 2,8
• Potasyum → % 2,6
• Magnezyum → % 2,1
Kaynak;
http://www.fenokulu.net
Hazırlayan:Kayseri Mithatpaşa İlköğretim Okulu Fen ve Teknoloji öğretmeni Murat ÜSTÜNDAĞ
çamaşır makinesi ses çıkarması topuz modelleri kapalı huawei hoparlör cızırtı hususi otomobil fiat doblo kurbağalıdere parkı ecele sitem melih gokcek jelibon 9 sınıf 2 dönem 2 yazılı almanca 150 rakı fiyatı 2020 parkour 2d en iyi uçlu kalem markası hangisi doğduğun gün ayın görüntüsü hey ram vasundhara das istanbul anadolu 20 icra dairesi iletişim silifke anamur otobüs grinin 50 tonu türkçe altyazılı bir peri masalı 6. bölüm izle sarayönü imsakiye hamile birinin ruyada bebek emzirdigini gormek eşkiya dünyaya hükümdar olmaz 29 bölüm atv emirgan sahili bordo bereli vs sat akbulut inşaat pendik satılık daire atlas park avm mağazalar bursa erenler hava durumu galleria avm kuaför bandırma edirne arası kaç km prof dr ali akyüz kimdir venom zehirli öfke türkçe dublaj izle 2018 indir a101 cafex kahve beyazlatıcı rize 3 asliye hukuk mahkemesi münazara hakkında bilgi 120 milyon doz diyanet mahrem açıklaması honda cr v modifiye aksesuarları ören örtur evleri iyi akşamlar elle abiye ayakkabı ekmek paparası nasıl yapılır tekirdağ çerkezköy 3 zırhlı tugay dört elle sarılmak anlamı sarayhan çiftehan otel bolu ocakbaşı iletişim kumaş ne ile yapışır başak kar maydonoz destesiyem mp3 indir eklips 3 in 1 fırça seti prof cüneyt özek istanbul kütahya yol güzergahı aski memnu soundtrack selçuk psikoloji taban puanları senfonilerle ilahiler adana mut otobüs gülben ergen hürrem rüyada sakız görmek diyanet pupui petek dinçöz mat ruj tenvin harfleri istanbul kocaeli haritası kolay starbucks kurabiyesi 10 sınıf polinom test pdf arçelik tezgah üstü su arıtma cihazı fiyatları şafi mezhebi cuma namazı nasıl kılınır ruhsal bozukluk için dua pvc iç kapı fiyatları işcep kartsız para çekme vga scart çevirici duyarsızlık sözleri samsung whatsapp konuşarak yazma palio şanzıman arızası